根据《体外诊断试剂注册与备案管理办法》的规定,已注册的第二类体外诊断试剂产品,发生的除设计、原材料、生产工艺、适用范围、使用方法等实质性变化,有可能影响该体外诊断试剂安全、有效的,注册人应当向原注册部门申请办理变更注册手续外的其他变化,应当在变化之日起30日内向原注册部门备案。
注册人名称和住所、代理人名称和住所等,属于前款规定的需要备案的事项。境内体外诊断试剂生产地址变更的,注册人应当在办理相应的生产许可变更后办理备案。
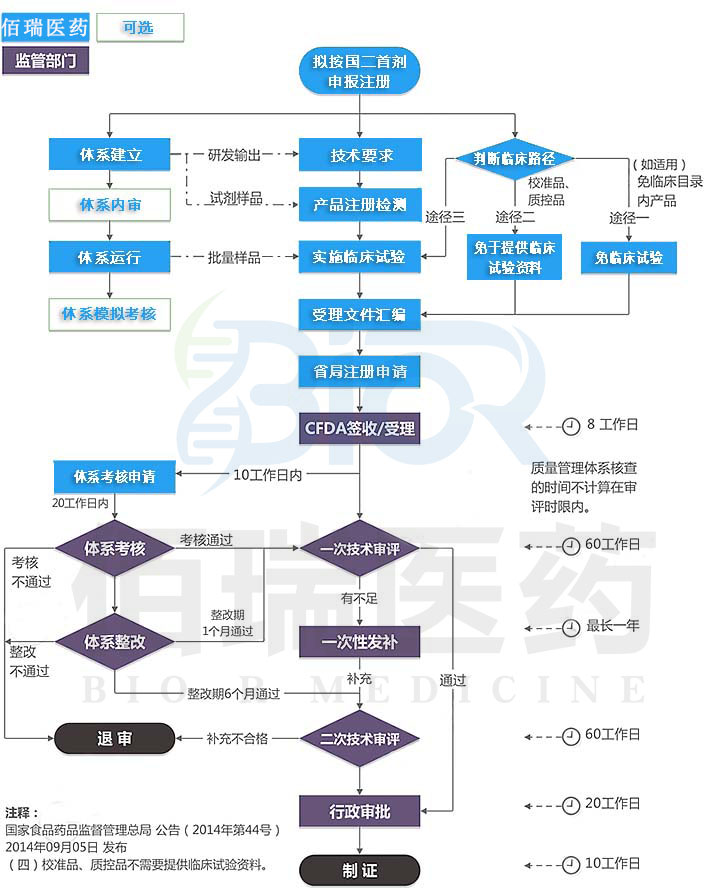
注册登记事项变更不收取变更申请费用。
文件名称 | 文号 |
《医疗器械监督管理条例》 | 国务院令第739号 |
《体外诊断试剂注册与备案管理办法》 | 国家市场监督管理总局令第48号 |
《医疗器械说明书和标签管理规定》 | 国家食品药品监督管理总局令第6号 |
《医疗器械生产监督管理办法》 | 国家食品药品监督管理总局令第7号 |
国家食品药品监督管理总局关于发布医疗器械生产质量管理规范的公告 | 2014年第64号 |
关于发布医疗器械产品技术要求编写指导原则的通告 | 2022年第8号 |
关于发布体外诊断试剂说明书编写指导原则的通告 | 2014年第17号 |
关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告 | 2021年第122号 |
关于医疗器械生产质量管理规范执行有关事宜的通告 | 2014年第15号 |
关于发布体外诊断试剂临床试验技术指导原则的通告 | 2021年第72号 |
预算、合同、考虑期,0.5个月。
资料收集 5工作日
申报资料撰写 5工作日
资料确认、盖章 5工作日
变更备案法规时间15个工作日,约1个月
立项后 约1-2个月
II类IVD国内注册登记事项变更服务
III类IVD国内注册登记事项变更服务